Тяжелые ожоги представляют одну из наиболее сложных медицинских проблем, связанную не только с непосредственной угрозой жизни, но и с длительным, часто неудовлетворительным восстановлением кожного покрова. Несмотря на значительные достижения в области реанимации и хирургического лечения, окончательное восстановление функциональных и эстетических свойств кожи остается серьезным вызовом для мировой медицины. Традиционные методы аутодермопластики, хотя и спасают жизни, часто оставляют пациентов с обширными рубцами, контрактурами и нарушенными функциями, что существенно снижает качество жизни и требует многолетней реабилитации. На этом фоне разработка исследователей из Университета Линчепинга (Швеция) открывает новые перспективы в области регенеративной медицины.
Современным золотым стандартом лечения глубоких ожогов является пересадка расщепленного кожного лоскута. Этот метод предполагает использование тонкого слоя собственной кожи пациента (эпидермиса и части дермы), который переносится на подготовленную раневую поверхность. Однако ключевое ограничение данного подхода кроется в его анатомической неполноценности.
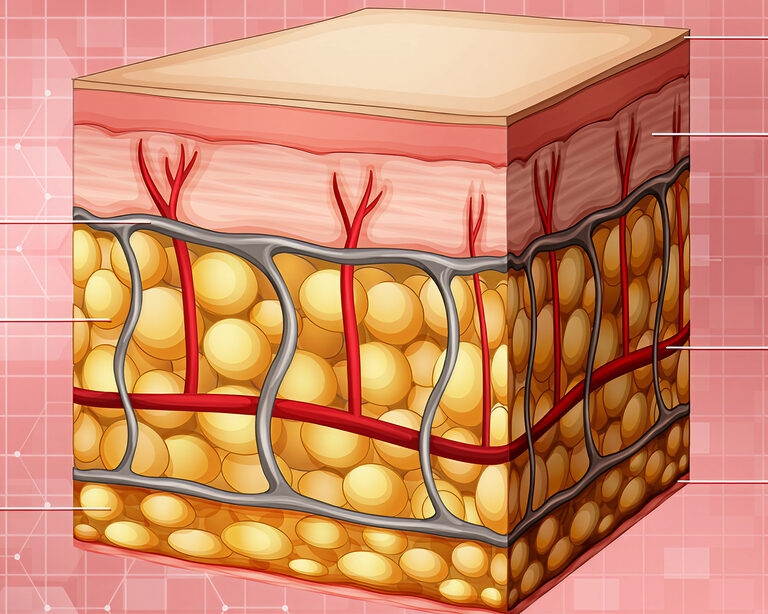
- Эпидермис vs. дерма: Пересаживаемый лоскут содержит преимущественно эпидермис — верхний защитный слой кожи. Критически важный глубокий слой, дерма, при этом отсутствует или представлен минимально.
- Роль дермы: Дерма — это сложный структурный каркас, содержащий кровеносные сосуды, лимфатические капилляры, нервные окончания, волосяные фолликулы, потовые и сальные железы, а также фибробласты, продуцирующие коллаген и эластин. Именно дерма отвечает за механическую прочность, эластичность, упругость кожи, ее способность к терморегуляции и сенсорным функциям.
- Проблема рубцевания: Отсутствие полноценной дермы при пересадке приводит к формированию неорганизованной волокнистой соединительной ткани — гипертрофических или келоидных рубцов. Эти рубцы не только создают косметический дефект, но и часто вызывают функциональные ограничения (контрактуры), нарушают потоотделение и чувствительность, становясь источником хронического дискомфорта и боли.
Суть инновации: "Кожа в шприце"
Исследовательская группа под руководством профессора Микаэля Миккельсона предложила принципиально новый подход к регенерации полноценной кожи, фокусирующийся на восстановлении именно дермального слоя. Их разработка получила неформальное название «кожа в шприце», что точно отражает ее ключевые преимущества — простоту применения и биологическую активность.
- Философия подхода. «Стройматериалы» вместо готового «дома». Вместо попыток создать в лаборатории сложную трехмерную структуру дермы со всеми ее компонентами, что пока технически крайне затруднительно, ученые пошли другим путем. Они предложили имплантировать в рану «строительные блоки» — живые клетки, способные самостоятельно организоваться и сформировать новую ткань под влиянием сигналов организма.
- Ключевой агент. Фибробласты. В качестве этих «строителей» были выбраны фибробласты — основные клетки соединительной ткани дермы. Эти клетки относительно легко культивируются в лабораторных условиях в больших количествах. Их уникальность в том, что они являются мультипотентными стромальными клетками: под воздействием биохимических сигналов организма они могут дифференцироваться в различные типы клеток, необходимые для построения дермы, и активно синтезировать внеклеточный матрикс (коллаген, эластин).
- Инженерное решение: микрокаркас для клеток. Чтобы обеспечить клеткам опору и создать начальную трехмерную среду, ученые поместили фибробласты на микроскопические шарики из желатина, модифицированного метакрилатными группами (GelMA). Этот материал был выбран не случайно: его состав и структура близки к естественному коллагену кожи, что улучшает выживаемость и функциональную активность клеток. Диаметр шариков составляет примерно 200 микрон (0.2 мм), что создает оптимальную поверхность для клеточной адгезии и пролиферации.
- Формула геля: стабильность и удобство. Свободно плавающие клетки на шариках не удержатся в ране. Для решения этой проблемы исследователи создали специальный гель-носитель. Основу геля составила гиалуроновая кислота — естественный компонент кожи, играющий ключевую роль в гидратации и заживлении. Модифицированная метакрилатными группами гиалуроновая кислота (HAMA) была смешана с суспензией клеток на GelMA-шариках.
- «Волшебное» отверждение: формирование имплантата. Ключевым этапом является формирование стабильного имплантата непосредственно на ране. Для этого подготовленный гель смешивается с фотоинициатором и наносится на поврежденную поверхность. Под воздействием безопасного синего света (длина волны ~400-500 нм) происходит реакция фотоотверждения: цепи метакрилатных групп гиалуроновой кислоты и желатиновых шариков сшиваются, образуя прочный, эластичный и биосовместимый гидрогель. Этот процесс занимает менее минуты, а полученный материал надежно фиксируется в ране, создавая защитное покрытие и «инкубатор» для клеток.
Экспериментальное подтверждение
От лаборатории к живой ткани
Теоретическая концепция требовала строгой экспериментальной проверки на живых организмах. Исследователи провели серию доклинических испытаний на моделях грызунов.
- Методика: С помощью технологии 3D-биопечати были созданы небольшие пластины из разработанного биокомпозитного геля, содержащие живые фибробласты человека на GelMA-шариках, в матриксе из фотоотвержденного HAMA. Эти пластины были имплантированы под кожу лабораторных мышей.
- Результаты выживаемости клеток: Мониторинг показал, что фибробласты не только успешно пережили сам процесс биопечати и имплантации, но и сохраняли высокую жизнеспособность (более 90%) в течение минимум 14 дней в новой среде. Это критически важно, так как массовая гибель клеток после трансплантации сводит на нет эффективность метода.
- Функциональная активность: Иммуногистохимический анализ и ПЦР-исследования тканей, окружающих имплантат, выявили активную экспрессию генов и секрецию ключевых белков внеклеточного матрикса дермы: коллагена I и III типов, фибронектина. Это прямое свидетельство того, что трансплантированные фибробласты не просто выжили, но и начали выполнять свою основную функцию — синтезировать каркас новой дермы.
- Васкуляризация: ключевой прорыв. Наиболее значимым результатом стала индукция ангиогенеза — процесса образования новых кровеносных сосудов. В течение 3-4 недель после имплантации исследователи наблюдали активное врастание капилляров мыши-реципиента в трансплантат. Сосудистая сеть формировалась как на границе имплантата с окружающей тканью, так и внутри него. Образование функционального кровоснабжения является абсолютно необходимым условием для выживания и интеграции любой крупной ткани или имплантата в организме. Без адекватной васкуляризации трансплантат неизбежно подвергается некрозу.
По оценкам независимых аналитиков, при условии успешного преодоления всех этапов и достаточном финансировании, технология может выйти на рынок не ранее чем через 7-10 лет. Инновационный биокомпозитный гель с живыми фибробластами, разработанный в Университете Линчепинга, представляет собой значительный шаг вперед в области восстановления кожи после тяжелых повреждений. Его концепция — доставка «строительных клеток» в удобной, фиксируемой форме, способных под руководством организма формировать новую, функциональную дерму — открывает путь к принципиально новому качеству заживления ожогов и других обширных ран. Доказанная жизнеспособность клеток, их функциональная активность и, что особенно важно, индуцированная васкуляризация в доклинических моделях обосновывают высокие ожидания.
Путь к широкому клиническому применению еще долог и сопряжен с необходимостью решения сложных научно-технических и регуляторных задач, потенциал технологии очевиден. Она не только сулит улучшение качества жизни для миллионов пациентов с ожоговой травмой во всем мире, но и служит ярким примером прогресса в конвергентных областях науки: клеточной биологии, биоматериаловедении, тканевой инженерии и трансляционной медицине.













 Кардиология
Кардиология Инфектология
Инфектология Онкология
Онкология Фертильность
Фертильность Нефрология
Нефрология Эндокринология
Эндокринология